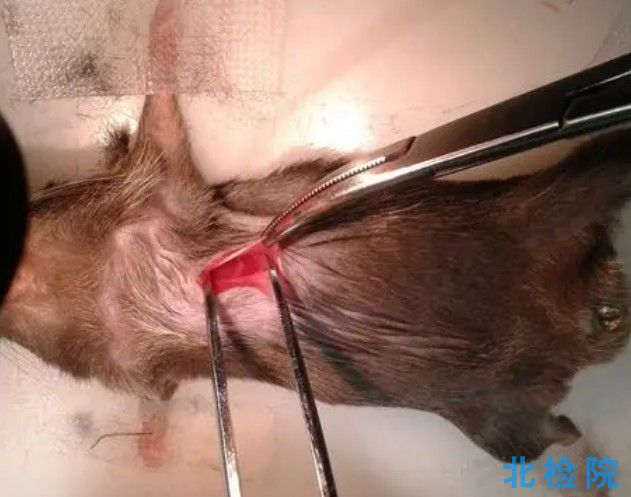
注意:因業務調整,暫不接受個人委托測試望見諒。
基本信息

品系名稱:B6-Map2k4tm1小鼠
英文名稱:B6-Map2k4tm1 mouse
疾病名稱:腫瘤、心腦血管疾病
相關基因:Map2k4
背景品系:C57BL/6J
遺傳類型:基因敲除
繁殖方式:HOM X HOM
繁殖代數:NA
研究用途:主要用于腫瘤、心腦血管疾病等及信號轉導方面的研究。
飼養環境:屏障或隔離環境
培育單位:北京華阜康生物科技股份有限公司、中國醫學科學院醫學實驗動物研究所
保種單位:中國醫學科學院醫學實驗動物研究所
資源鑒定:否
鑒定日期:暫無介紹
特征描述
絲裂原活化蛋白激酶的激酶英文名稱: MAPKKINASE4(Map2k4,MKK4,JNKK1,SEK1)
MKK4的結構、分布及作用機制
MKK4位于染色體 17p11.2, 其編碼由 399 個氨基酸組成。 主要位于細胞質中, 細胞核中也能檢測出MKK4。Sanchez等1993年第一次在鼠體內克隆出 SEK1(srtess-activatedproteinkinasekinase), Derijard等首次在人體內克隆出 MKK4。 MKK4蛋白含有 2個停泊位點, 即位于 N端的D區停泊位點和位于 C端的 DVD區停泊位點。MKK4 MRNA幾乎在人類的各種組織中均有表達, 其中在腦組織中的表達水平最高。MKK4作為 MAPK信號傳導通路的重要組成部分, 主要通過 JNK通路與 p38 通路發揮作用。 c-Jun氨基末端激酶(JNK)又稱為應激活化蛋白激酶(SAPK), 在目前成熟人腦細胞中已克隆了 10個 JNK異構體, 它們分別由 JNK1、JNK2和 JNK3基因編碼, 相對分子質量 46 kD的 JNK1和 55 kD的JNK2在各種組織細胞中廣泛表達, 而 JNK3選擇性在腦細胞中表達。JNK/SAPK信號通路可被應激刺激、細胞因子、生長因子及某些 G蛋白偶聯的受體激活。 外界刺激可通過 Ras依賴或非 Ras依賴的兩條途徑激活 JNK, 小分子 G蛋白 Ras超家族的成員之一 Rho可能也是 JNK激活的上游信號, Rho蛋白 Rac及 cdc42的作用可能是與 p21 激活的絲 /蘇氨酸激酶PAK結合, 使其自身磷酸化而被激活, 而活化的 PAK進一步使 JNK激活。 已有研究證實, 雙特 異性激酶 JNKKinase(JNKK)是 JNK/SAPK的上游激活物 , 包括 MKK4(JNKK1)、MKK7(JNKK2), 其中MKK7/JNKK2 可特異性地激活JNK, 而 MKK4則可同時激活 JNK1和p38。JNKK的上游激活物為 MEKK, MEKK1 在體外過表達時可激活 MEK, 但MEKK1在體內高度選擇性地磷酸化MKK4, 從而激活JNK。MEKK2 也可通過 MKK4 激活 JNK和 p38。JNK/SAPK接受上游信號被激活后, 可進一步使核內的轉錄因子c-Jun氨基末端 63及 73位的絲氨酸殘基磷酸化, 進而激活c-Jun而增強其轉錄活性。p38MAPK存在于哺乳動物的細胞內, 其通路激活劑與JNK通路相似。 部分能夠激活 JNK的促炎因子、應激刺激亦可激活 p38, 此外, p38還可被脂多糖及 G+細菌細胞壁成分所激活。 p38信號通路也由三級激酶鏈組成, 其上游激活物為 MKK3、MKK4 及 MKK6, 與 MKK4不同, MKK3、MKK6僅特異性激活 p38。 體外細胞轉染實驗表明, MEKK2、MEKK3可通過激活MKK4同時激活JNK和p38, 而 MEKK3通過激活 MKK3特異性激活p38。 不同的 p38 異構體對同一刺激可有不同的反應, 不同的異構體對底物的作用也具有選擇性。
MKK4與惡性腫瘤的關系
近來研究表明, 絲裂原活化蛋白激酶信號轉導功能是控制細胞過程的關鍵因素, 參與許多生物學途徑。 MKK4在惡性腫瘤的發生發展過程中的調節作用, 部分研究認為有腫瘤抑制作用, 但也有研究認為有促腫瘤作用。
MKK4的腫瘤抑制作用
MKK4基因位于人類染色體17p11.2, 與抑癌基因 p53 相距約 10 cm, 文獻報道約 5%的腫瘤組織會發生 MKK4基因突變, 因此認為 MKK4對惡性腫瘤有直接的抑制作用;對前列腺癌和卵巢癌轉移也具有抑制作用。 研究發現, 編碼 MKK4蛋白的基因位點均表現為純合子缺失;在對 88株雜合子人類細胞株進行研究, 發現在胰腺癌、乳腺癌、結直腸癌、睪丸癌中, MKK4突變的發生率是 6/213, 約3%, 主要表現為同合子缺失和基因突變, 因此,MKK4可能對某些類型的腫瘤或細胞轉移具有抑制作用。Yeasmin等在研究 MKK4蛋白表達下調與卵巢癌的發展機制中發現, 過度表達的 MKK4 TOV- 21G細胞, 在純合子缺失時可出現散在的、成纖維細胞樣集聚性生長的細胞形態學變化, 通過傳染表達 MKK4 得到的 TOV- 21 G細胞, 細胞侵襲能力明顯下降。 在具有 MKK4 高度表達能力的 MDAH2774細胞中敲除基因 MKK4后, 浸潤明顯加強;對 SKOV3細胞的研究也出現了上述與 TOV- 21 G細胞相同的結果, 這種突變導致 E-鈣黏蛋白(E-cad)表達下調, 使上皮細胞間質轉化增強, 導致腫瘤細胞轉移。上皮細胞間質轉化(EMT)是具有極性的上皮細胞轉換成為具有移行能力的間質細胞并獲得侵襲和遷移能力的過程, 其存在于人體多個生理和病理過程中。 EM與腫瘤細胞的侵襲和轉移有著密切的關系。 E-鈣黏蛋白用于維持正常細胞間連接的穩定性, 其表達水平與EMT的發生以及腫瘤的侵襲能力呈負相關, 是 EMT的關鍵分子, Twist也可誘導 EMT的發生, EMT的腫瘤細胞可獲得某些類似于干細胞的能力如自我更新等, 而胚胎干細胞在分化時伴有類似 EMT過程的分子生物學事件。
MKK4對腫瘤的促進作用
Wu等報道胃腺癌組織中表達 MKK4蛋白者無復發生存率和總生存率明顯低于不表達者。 Lotan等報道 MKK4、MKK6和 MKK7在人前列腺癌組織及具有廣泛的高級別前列腺上皮內瘤患者 (HGPIN)和小鼠前列腺癌組織中表達增加。 Khatlani等研究發現突變體有絲分裂原激活蛋白激酶激酶 4(MKK4)進入人體支氣管上皮細胞系 BEAS-2B和 HB56B可增加細胞增殖、遷移、侵襲和聚落生成。 由于 MKK4的突變, 導致 RNABEAS- 2B細胞轉化表型的逆轉, 從而使 JNK通路的活化, 導致腫瘤發生。
MKK4與惡性腫瘤臨床及預后的關系
Cunningham等采用基因芯片技術測定 133例胃癌術后患者的正常胃組織、腸上皮化生組織和異型增生上皮組織 MKK4 表達, 認為MKK4有助于診斷胃癌癌前病變。 Cunningham等回顧性分析了 1983 ~ 1995年 124例胃癌術后患者的預后, 發現 5年生存率隨 MKK4表達增強而升高, 認為 MKK4蛋白表達的高低可預測胃癌患者預后【1】。
有報道指出 JNKK1蛋白表達與乳腺癌轉移密切相關, 檢測JNKK1蛋白表達可作為診斷與治療乳腺癌的參考指標【2】。
絲裂原活化蛋白激酶的激酶(Mitogen-activated protein kinase kinase-4,MKK4)被稱為腫瘤轉移抑制基因,是MAPK(mitogen-activated protein kinase)家族中的一個成員,位于人類17號染色體。4%胰腺癌中可見絲裂原活化蛋白激酶4基因突變和純合性缺失,伴隨有應激活化蛋白激酶通路的失調【3】。
MAP2K4、BRCA1在年輕EC患者中呈低表達,SUMO-1呈高表達,且其表達與患者臨床病理參數及生存率密切相關【4】。
MKK4與缺血性中風
MAP2K4基因rs3826392多態性與缺血性中風風痰瘀阻證、氣虛血瘀證的易感性無關聯(P〉0.05)。但未觀察到MAP2K4基因rs3826392多態性與缺血性中風風痰瘀阻證、氣虛血瘀證的血脂水平具有關聯(P〉0.05)【5】。
動物簡介
MKK4(mitogen-activated protein kinase kinase4)是絲裂原活化蛋白激酶的激酶,是 MAPK信號傳導通路的組成部分, 是癌基因 Ras信號傳導通路的中心環節。MKK4在惡性腫瘤中扮演著重要角色。
營養成分
飼料營養成分:水分≤10%;粗蛋白≥20%;粗脂肪≥4%;粗纖維≤5%;粗灰分≤8%;鈣1.0-1.8%;磷0.6-1.2%。
生物學特性
生長曲線:無壽命:1-2年解剖學:無繁殖學:近交繁殖自發異常:無生理生化指標:無
遺傳信息
根據Map2k4基因組結構和蛋白功能保守區,Map2k4有多個轉錄產物。Exon4位于蛋白功能保守區:而且基因移碼突變后,基因無法正確翻譯,蛋白失活。因此決定在exon4內設計gRNA靶點,使基因移碼突變。下面將根據exon4設計移碼突變敲除方案。轉錄產物Map2k4-001的基因組結構:
實驗儀器




測試流程
注意事項
1.具體的試驗周期以工程師告知的為準。
2.文章中的圖片或者標準以及具體的試驗方案僅供參考,因為每個樣品和項目都有所不同,所以最終以工程師告知的為準。
3.關于(樣品量)的需求,最好是先咨詢我們的工程師確定,避免不必要的樣品損失。
4.加急試驗周期一般是五個工作日左右,部分樣品有所差異
5.如果對于(B6-Map2k4tm1小鼠,動物試驗)還有什么疑問,可以咨詢我們的工程師為您一一解答。
上一篇: B6-Ldlrtm1小鼠,動物試驗
下一篇: B6-Mhc1tm1小鼠,動物試驗
- 農藥測試閱讀:11
- LAM2-DC小鼠閱讀:0
- APP敲除小鼠,動物試驗閱讀:1
- MHC單倍型鴨HVRI:HBW/B(n),動物試驗閱讀:1
- 動物血清測試閱讀:17
- ICR小鼠,動物試驗閱讀:0
- Kdr條件性敲除小鼠,動物試驗閱讀:1
- hCTLA-4閱讀:0
- LOY-AG小鼠閱讀:0
- CIS-AD小鼠閱讀:0
-
服務保障 一對一品質服務
-
定制方案 提供非標定制試驗方案
-
保密協議 簽訂保密協議,嚴格保護客戶隱私
-
全國取樣/寄樣 全國上門取樣/寄樣/現場試驗